করোনাকালীন সময়ে এই ১৫ সপ্তাহের অ্যাসাইনমেন্ট হতে পারে তোমাদের শেষ অ্যাসাইনমেন্ট। আজকের আয়োজন ৭ম শ্রেণির বিজ্ঞান ১৫ সপ্তাহের অ্যাসাইনমেন্ট সমাধান ২০২১। এটার পরেই তোমাদের দেওয়া হবে ১৫ সপ্তাহের কর্ম ও জীবনমুখি অ্যাসাইনমেন্ট উত্তর।
৭ম শ্রেণির বিজ্ঞান ১৫ সপ্তাহের অ্যাসাইনমেন্ট সমাধান ২০২১
প্রিয় শিক্ষার্থী বন্ধুরা তোমদের নিশ্চয় মনে আছে ১২ সপ্তাহে তোমাদের বিজ্ঞান, কর্ম ও জীবনমুখি অ্যাসাইনমেন্ট দেওয়া হয়েছিলো। এবং ১৬ সপ্তাহে যদি তোমাদের এসাইনমেন্ট দেওয়া হয় তবে তোমাদের ইংরেজি, বাংলাদেশ ও বিশ্বপরিচয় অ্যাসাইনমেন্ট দেওয়া হবে।
আরো পড়ুনঃ
তোমরা হয়তো জানো গত ১২ তম সপ্তাহে তোমাদের বিজ্ঞান এসাইনমেন্টের একটি সুন্দর উত্তর আমরা তোমাদের উপহর দিয়েছিলাম। আজকের পঞ্চদশ সপ্তাহের বিজ্ঞান এসাইনমেন্টটিও তেমন সুন্দর হবে বলে আশা করছি।
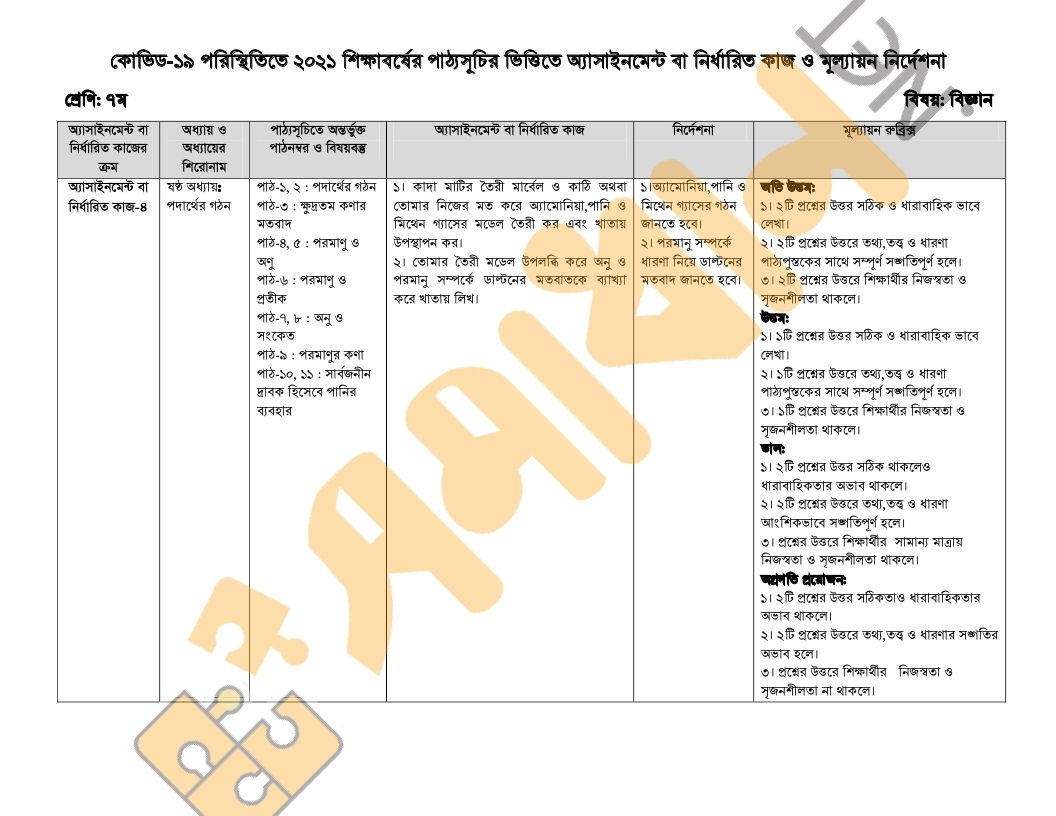
১৫ সপ্তাহের ৭ম শ্রেণির বিজ্ঞান অ্যাসাইনমেন্ট প্রশ্নসমূহ
শ্রেণিঃ সপ্তম
অধ্যায়ঃ চতুর্থ অধ্যায় (পদার্থের গঠন)
বিষয়বস্তুঃ
- পাঠ-১, ২ : পদার্থের গঠন
- পাঠ-৩ : ক্ষুদ্রতম কণার মতবাদ
- পাঠ-৪, ৫ : পরমাণু ও অণু
- পাঠ-৬ : পরমাণু ও প্রতীক
- পাঠ-৭, ৮ : অনু ও সংকেত
- পাঠ-৯ : পরমাণুর কণা
- পাঠ-১০, ১১ : সার্বজনীন দ্রাবক হিসেবে পানির ব্যবহার
- কাদা র তৈরী মার্বেল ও অথবা তোমার নিজের মত করে আ্যমোনিয়া,পানি ও মিথেন গ্যাসের মভেল তৈরী কর এবং খাতায় উপস্থাপন কর।
- তোমার তৈরী মডেল উপলব্ধি করে অনু ও পরমানু সম্পর্কে ভান্টনের মতবাতকে ব্যাখ্যা করে খাতায় লিখ।
৭ম শ্রেণির বিজ্ঞান ১৫ সপ্তাহের অ্যাসাইনমেন্ট উত্তর ২০২১
১নং প্রশ্নের উত্তর
অ্যামোনিয়া অনুর মডেলঃ
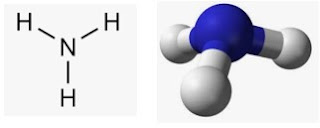 |
| চিত্রঃ মডেল অ্যামোনিয়া |
অ্যামোনিয়া (NH₃) একটি তীব্র ঝাঝালো হাইড্রোজেন ও নাইট্রোজেন দ্বারা গঠিত গ্যাস। এটির একটি অনুতে একটি নাইট্রোজেন পরমাণু এবং তিনটি হাইড্রোজেন পরমাণু বিদ্যমান। অ্যামোনিয়া অনুর গঠন আকৃতি পিরামিডিও। হাইড্রোজেন পরমাণু গুলোর মধ্যেকার বন্ধন কোণ ১০৬.৭٥। অ্যামোনিয়া খুবই গুরুত্বপূর্ণ একটি গ্যাস। বাণিজ্যিকভাবে এর অনেক ব্যবহার রয়েছে। জীবজগতেও এর অনেক বড় একটি ভূমিকা রয়েছে। নাইট্রোজেন ঘটিত সার ইউরিয়া উৎপাদনে এটি ব্যবহ্রত হয়।
পানির অনুর মডেলঃ
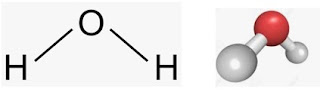 |
| চিত্রঃ মডেল পানি |
পানির অনুর সংকেত (H₂O)। একটি পানির অনুতে দুটি হাইড্রোজেন পরমাণু ও একটি অক্সিজেন পরমাণু বিদ্যমান। পানি তিন অবস্থায় থাকতে পারে যথা কঠিন, তরল , ও বায়বিয়। পানির মধ্যকার বন্ধন কোন ১০৪.৫٥। পানি একটি পোলার যৌগ। তাই এতে সকল অজৈব যৌগ দ্রবীভূত হয়। পানি স্ফুটনাংক ১০০٥ সেলসিয়াস।
মিথেন অনুর মডেলঃ
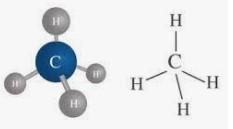 |
| চিত্রঃ মডেল মিথেন |
মিথেন অনুর সংকেত (CH₄)। এটি একটি বর্ণহীন ও গন্ধহীন গ্যাস। একটি মিথেন অনুতে একটি কার্বন পরমাণু এবং চারটি হাইড্রোজেন পরমাণু বিদ্যমান। পরমাণুসমূহ পরস্পরের সাথে ইলেকট্রন শেয়ারের মাধ্যমে যুক্ত থাকে। মিথেন অনুর আকৃতি চতুস্থলকীয়। মিথেন অনুতে হাইড্রোজেনের মধ্যে ১০৯.৫٥ কোণ বিদ্যমান।
২নং প্রশ্নের উত্তর
ডাল্টলের পরমাণুবাদঃ ১৮০৩ সালে ইংরেজ পদার্থ ও রসায়ন বিজ্ঞানী জন ডাল্টন পরমাণু সম্পর্কে একটি তত্ব প্রকাশ করেন যা ডাল্টলের পরমাণুবাদ নামে সুপরিচিত। তার প্রদত্ত পরলাণুবাদে মোট পাঁচটি স্বীকার আছে। এই স্বীকার্য পাঁচটি হলো উপরের মডেল অনুযায়ী ব্যাখ্যা করা হলো।
১ম স্বীকার্যঃ পদার্থ অতি ক্ষুদ্র কণা দ্বারা গঠিত এই কণাগুলোর নাম পরমাণু।
ব্যাখ্যাঃ অ্যামোনিয়া, পাণি ও মিথেন অনুগুলো নাইট্রোজেন, হাইড্রোজেন, ও অক্সিজেন নামক পরমাণু দ্বারা গঠিত। যা অতি ক্ষুদ্র।
২য় স্বীকার্যঃ একই পদার্থের পরমাণুসমূহের ধর্ম, ভর একই। কিন্তু ভিন্ন ভিন্ন পদার্থের ধর্ম ও ভর ভিন্ন।
ব্যাখ্যাঃ সকল অ্যামোনিয়া অনুর ধর্ম ও ভর (১৭) একই অর্থাৎ এরা ঝাঝালো গন্ধযুক্ত। কিন্তু অ্যামোনিয়ার সাথে পানির ও মিথেন অনুর ধর্ম ও ভরে মিল নাই। যেমন অ্যামোনিয়ার ভর ১৭, পানির অনুর ভর ১৮, মিথেন অনুর ভর ১৬।
৩য় স্বীকার্যঃ পরমাণুসমূহ বিভাজিত, সৃষ্টি বা ধ্বংস হতে পারে না।
ব্যাখ্যাঃ অ্যামোনিয়া, পানি ও মিথেন অনুর নাইট্রোজেন, হাইড্রোজেন ও অক্সিজেনকে সৃষ্টি ধ্বংস করা যাবে না।
৪র্থ স্বীকার্যঃ সরল পূর্ণসংখ্যক অনুপাতে বিভিন্ন পদর্ধের পরমাণু সংযুক্ত হয়ে রাসায়নিক যৌগের সৃষ্টি করে।
ব্যাখ্যাঃ অ্যামোনিয়া অনু গঠনে সবসময় নাইট্রোজেন ও হাইড্রোজেনের অনুপাত হবে ১:৩। তেমনি পানির অনুর গঠনে অক্সিজেন ও হাইড্রোজেনে পরমাণুর অনুপাত হবে ১:২। এবং মিথেন অনুর গঠনে কার্বন ও হাইড্রোজেন পরমাণুর অনুপাত হবে ১:৪। কখনই ১টি কার্বন ৫টি হাইড্রোজেনের সাথে বিক্রিয়া করবেনা।
৫ম স্বীকার্যঃ রাসায়নিক বিক্রয়াসমূহে পরমাণু অংশগ্রহণ করে।
ব্যাখ্যাঃ অ্যামোনিয়া গঠনের সময় হাইড্রোজেন ও নাইট্রোজেন পরমাণু পরস্পরের সাথে বিক্রিয়া করে অ্যামোনিয়া উৎপন্ন করেছে। আবার অ্যামোনিয়া যদি কোনো পদার্থের সাথে বিক্রিয়া করে তবে কেবল হাইড্রোজেন ও নাইট্রোজেন বিক্রিয়ায় অংশগ্রহণ করবে কিন্তু অ্যামোনিয়া বিক্রিয়ায় অংশগ্রহণ করবেনা।
আরো পড়ুনঃ
- ৭ম শ্রেণির বিজ্ঞান অ্যাসাইনমেন্ট ১৯ সপ্তাহ উত্তর ২০২১
- ১৫ সপ্তাহের ৭ম শ্রেণির কর্ম ও জীবনমুখি শিক্ষা এসাইনমেন্ট উত্তর
বিজ্ঞান অ্যাসাইনমেন্টটি তোমাদের অনেকটা ব্যবহারিক ভিত্তিক। তাই তোমাদের অ্যাসাইনমেন্টটি করতে মজা লাগার কথা। তোমরা উক্ত অনুর মডেল গুলি কাদা বা কাঠি দিয়ে বানাতে পারো।
১৫ সপ্তাহের বিজ্ঞান অ্যাসাইনমেন্ট সপ্তম শ্রেণি
আমাদের সাথে থাকতে আমাদের ফেজবুক পেজে লাইক দিয়ে রাখো। অথবা আমাদের এসাইনমেন্ট ফেজবুক গ্রুপে যুক্ত হতে পারো। এসাইনমেন্টগুলো ভিডিও আকারে পেতে আমাদের ইউটিউব চ্যনেলটি সাবসক্রাইব কর।

আমাদের ইউটিউব লিংক
https://www.youtube.com/channel/UCea_DqYt9NegZgE5A-mdIag
ফেজবুক পেজ (সমস্যা ও সমাধান)
https://web.facebook.com/shomadhan.net
assignment all class (6-9)📝📝
https://web.facebook.com/groups/287269229272391




VcJf hcmd iWc ocYc